孙华冰课题组近日在《Angewandte Chemie International Edition》(IF=16.1)发表题为“Redox-inducible Radiomimetic Photosensitizers Selectively Suppress Cancer Cell Proliferation by Damaging DNA through Radical Cation Chemistry” 的文章。该研究开发了一种新型拟放疗光敏剂,可在细胞中产生DNA自由基阳离子,构建了用于放疗研究的全新细胞模型。同时也为深入理解放疗机制以及推动其临床应用提供了重要的理论支持。天津医科大学樊合利讲师和王洛博士为论文的共同第一作者。通讯作者为天津医科大学孙华冰教授和中国科学院深圳先进技术研究院梅辉研究员。

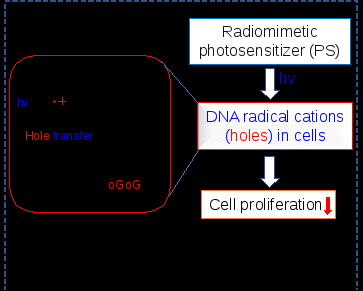
放疗是治疗癌症最常用的非手术方式之一,约有70%的肿瘤患者在疾病的不同阶段需要接受放疗。放疗通过直接和间接作用损伤DNA,进而诱导癌细胞死亡。在这些机制中,放疗的直接作用通过产生DNA自由基阳离子在癌症治疗中扮演着关键角色。然而,由于缺乏适当的研究模型,对于这些直接作用在细胞层面的影响我们仍知之甚少。
该研究成功开发了拟放疗光敏剂,能够有效产生DNA自由基阳离子,并且可以用于研究放疗直接效应在细胞中的作用。在DNA模型中,拟放疗光敏剂通过捕获AP位点成功整合到DNA中。在光照下,自由基阳离子被有效地生成,并能够在双链DNA中自由迁移,最终在dGGG单元中形成DNA损伤(8-oxoG/FapyG)。免疫荧光实验监测细胞内8-oxoG的变化,发现光敏剂处理组的荧光显著增强,进一步证明了自由基阳离子的生成和8-oxoG的产生。过量的DNA损伤及自由基阳离子引发的DNA-蛋白交联会触发DNA损伤应答并导致DNA链断裂。γH2AX免疫荧光和彗星实验明确证实了这一点。有趣的是,尽管在光诱导的自由基阳离子生成过程中会产生超氧阴离子,但细胞内的ROS水平并未显著改变。
研究还发现,由于癌细胞中具有更高水平的GSH,光敏剂前体对癌细胞表现出更大的毒性。周期和凋亡分析显示,放疗的直接作用或DNA自由基阳离子主要通过使细胞周期阻滞在G2/M期,而非直接诱导细胞凋亡,从而抑制了癌细胞的增殖。
综上所述,该研究开发了一种能够模拟放疗直接作用的新型光敏剂,并探究了其作用机制。这项工作不仅为光疗提供了一种新策略,还为深入研究放疗直接效应在细胞中的影响提供了可靠的工具。
该研究得到了国家自然科学基金、天津市自然科学基金、国家重点研发计划、天津医科大学基础医学“卓越人才计划”和天津医科大学大型仪器共享平台的大力支持,以及Anahit Campbell在论文撰写中的帮助。

