天津医科大学药学院孔德新教授课题组近期在Signal Transduct Target Ther(IF=38.104)发表题为“Stellettin B renders glioblastoma vulnerable to poly (ADP-ribose) polymerase inhibitors via suppressing homology-directed repair”的文章,报道了基于蛋白质组学发现海洋来源Stellettin B(STELB)通过靶向DNA双链损伤修复过程中的同源重组修复(Homology directed repair,HDR)增强PARP抑制剂(PARPi)对胶质母细胞瘤(GBM)的治疗效果。彭鑫博士、王营营博士和张少璐博士为该论文的共同第一作者。通讯作者为孔德新教授、美国St. John’s University的Zhe-Sheng Chen教授以及上海交通大学林厚文教授。

GBM是一类恶性程度极高的颅内肿瘤,缺乏有效的靶向药物,在临床治疗上面临很大挑战。作为基于“合成致死”的抗癌范式而研发的抗癌药,PARPi自问世以来,就掀起了在癌症治疗领域的“惊涛骇浪”,使得很多之前没有靶向药物可用的癌症患者(比如携带BRCA1/2突变的患者)开始有了受益于分子靶向治疗的希望。值得一提的是,PARPi在与GBM的一线治疗药物替莫唑胺联合,以及在辅助放射治疗中均表现出了较为理想的协同效果,目前均已进入临床试验阶段。不过如上述所说,PARPi所扮演的都还只是“辅助者”的角色,而由于GBM中BRCA突变相对罕见,使得PARPi在GBM治疗中的应用很受限。因此,更进一步地推进和扩展PARPi在GBM中的应用更是迫在眉睫的临床需要。
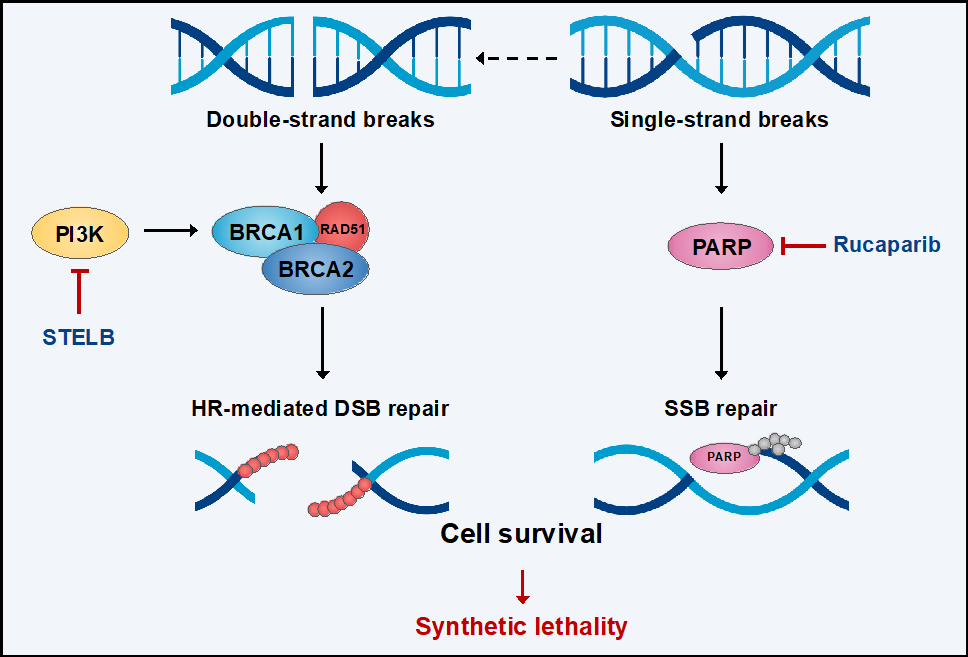
该研究基于数据驱动(Data-Driven)的研究范式,利用无偏倚的定量蛋白质组学测序,发现STELB显著影响了GBM细胞DNA修复相关蛋白的丰度,经GO及GSEA等富集分析证明STELB对DNA修复相关生物学进程具有显著的抑制作用。而PARPi抗肿瘤的主导机制即为诱导DNA单链断裂损伤(SSB),提示两者有潜在产生协同作用的可能。利用药物协同试验模型(ZIP Synergy Model)评估发现,STELB与PARPi联合给药能够产生协同抗GBM的效果,表现为增加的DNA双链断裂(DSB)以及最终的细胞凋亡。进一步利用基因过表达及敲减实验发现,STELB通过抑制PI3K信号通路来降低同源重组修复(HDR)的关键因子BRCA1/2及RAD51的表达,显著降低GBM细胞的HDR效率,从而达到使GBM细胞对PARPi更敏感的效果。而作为另一种DSB的主要修复方式,NHEJ的修复效率并没有显著变化,提示STELB对抗癌靶点存在特异的选择性。研究者还进一步证实了STELB与PARPi的联合使用在抑制体内实验动物模型的肿瘤生长方面具有很强的功效,其中斑马鱼及裸鼠GBM原位模型提示了其有穿透血脑屏障的潜力。
该项目的实施所利用的筛选策略为GBM候选药物的临床前研究提供了宝贵的实践经验。在未来的研究中,将对STELB的作用靶点进行深入探讨,以期为临床试验评估提供更多的信息。上述研究得到国家自然科学基金国际合作研究项目、面上项目、青年项目,中国博士后基金会博士后面上项目以及天津市新药创制科技重大专项等基金的支持。
作者介绍:孔德新,天津医科大学药学院,教授,博士生导师。天津市特聘教授,天津市重点领域创新团队“分子靶向药物研究创新团队”负责人,天津市高校药学学科领军人才。1994年毕业于山东大学药学院获硕士学位,之后在山东大学生科院任教,2000-2005年在日本大阪大学留学获博士学位。2005-2006年在香港中文大学、2006-2010年在日本癌症研究所工作。2010年10月加入天津医科大学药学院。中国生化与分子生物学会工业生化分会副主任委员、中国药理学会肿瘤药理专委会常委、中国抗癌协会抗癌药物专委会常委、中国老年学和老年医学学会肿瘤基础及转化研究专家委员会常委等。主要研究兴趣为PI3K抑制剂等小分子靶向抗癌药物,曾作为核心研究人员将PI3K抑制剂ZSTK474推向临床试验。发表SCI论文近100篇,回国后主持国家自然科学基金6项。

